一、单项选择题:1-30小题,每小题2分,共60分。下列每题给出的四个选项中,只有一个选项是符合题目要求的。
1.微观粒子具有的特征:
A。微粒性 B。波动性 C。波粒二象性 D。穿透性
2. 下列分子中,属于极性分子的是:
A.H2S B.BeF2 C.BF3 D.CH4
3. 下列浓度为0.1mol.L-1的溶液中,能用酸碱滴定法直接准确滴定的是:
A.NaAc B.NH4Cl C.Na3CO3 D. H3BO3
4.下列四种物质中,ΔfHmθ为零的物质是
A.C(金刚石) B. CO(g) C. CO2(g) D. Br2(1)
5.用NaC2O4标定KMnO4溶液时,滴定开始前不慎将被滴溶液加热至沸,如果继续滴定,则标定的结果将会
A。无影响 B。偏高 C。偏低 D。无法确定
6.化学反应N2(g)+3H2(g)=2NH3(g),其定压反应热Qp和定容反应热Qv的相对大小是
A. QpQv D。无法确定
7.在反应Ⅰ与Ⅱ中,ΔrHmθ(Ⅰ) >ΔrHmθ(Ⅱ) >0,若升高反应温度下列说法正确的是
A. 两个反应的平衡常数增大相同的倍数 B。两个反应的反应速率增大相同的倍数
C. 反应Ⅰ的平衡常数增加倍数较多 D。反应Ⅱ的反应速率增加倍数较多
8.定量分析中,多次平行测定的目的是
A。减小系统误差 B。减小偶然误差 C。避免试剂误差 D。避免仪器误差
9.下列各组量子数(n,1,m,ms)取值合理的为
A.3,2,3,+1/2 B. 3,2,-2,-1/2 C. 3,3,-1,+1/2 D. 3,-3,2,+1/2
10

11. 以二苯胺磺酸钠为指示剂,用重铬酸钾法测定Fe2+时,加入磷酸主要目的是:
A。增大突跃范围 B。防止Fe3+水解 C。调节溶液酸度 D。加快反映速率
12. 欲使原电池(-)Zn/Zn2+(c1) ∣∣Ag+(c2) ∣Ag(+)的电动势下降,可采取的方法为
A。在银半电池中加入固体硝酸银 B。在锌半电池中加入固体硫化钠
C。在银半电池中加入氯化钠 D. 在锌半电池中加入氨水
13.在碘量法测铜的实验中,加入过量KI的作用是
A。还原剂、沉淀剂、配位剂 B。氧化剂、配位剂、掩蔽剂
C。沉淀剂、指示剂、催化剂 D。缓冲剂、配位剂、处理剂
14. 一定条件下,乙炔可自发聚合为聚乙烯,此反应
A.ΔrHm>0、ΔrSm>0 B. ΔrHm<0、ΔrSm<0
C.ΔrHm>0、ΔrSm<0 D. ΔrHm<0、ΔrSm>0
15. 将溶液中7.16×104mol的MnO4-还原,需0.0660mol.L-1的Na2SO3溶液26.98mL,则Mn元素还原后氧化数为
A.+6 B.+4 C.+2 D.0
16. 苯丙氨酸和丙氨酸可以形成的二肽共有
A。二种 B。四种 C。六种 D。八种
17. 下列化合物中,存在顺反异构体的是
A.3-甲基-1,2-二溴-2-丁烯 B. 3-甲基-2,4-二溴-1-丁烯
C. 2-甲基-1,4-二溴-2-丁烯 D. 3-甲基-2,3-二溴-1-丁烯
18. 通过双烯合成(Diels-Alder反应)制备化合物的原料是
19.下列化合物中具有芳香性的是
20. 下列可用于制备化合物的反应是
21.下列化合物中,酸性最强的是
22.下列化合物中,所有手性碳原子都是R构型的是
23.化合物在酸催化下发生分子内脱水反应,其活性顺序是
A。(a)>(b)>(c) B. (c)>(a)>(b) C. (b)>(a)>(c) D. (b)>(c)>(a)
24.对氨基苯甲酸异丁酯的结构式是
25.下列化合物在水中溶解度最大的是
A。丙胺 B。二丙胺 C。三丙胺 D。苯胺
26. 糖苷能够稳定存在和发生水解的条件分别是
A。酸性,碱性 B。中性,酸性 C。中性,碱性 D。酸性,中性
27.吡啶在高温下与浓硝酸和浓硫酸作用,生成主要产物是
28.反应 的主要产物是
29.下列油脂中,皂化值最高的是
30. 区别3-戊酮和a-戊酮可用的试剂是
A。饱和 B。饱和 C。饱和 D. 饱和
二、填空题:31~55小题,每空1分,共35分。
31.热力学物理量H. Qp. W. Qv. 中,属于状态函数的是(1)
32. 浓度均为0.1mol.L-1的NH4Cl.NaPO4和NH4Ac水溶液,其PH由大到小的顺序为(2)
33.浓度为C的溶液可吸收40%的入射光,同样条件下,浓度为0.5c的同种溶液的透光度为(3)
34. 标定的氢氧化钠标准溶液,保存不当吸收了CO2,如果用其测定苹果中果酸总量,将产生(4)误差(填“正”或“负”)
35. Na2PO4水溶液的质子条件式为(5)
36.NCl3的分子构型作为(6),中心原子的杂化轨道类型是(7)
37.Br的元素电视图为其中发生歧化反应的物质是(8)和(9)
38.在电势分析中,参比电极要满足可逆性,重现性和(10)的基本要求;在分光光度法测定中,有色溶液对一定波长的单色光的吸收程度与溶液中吸光物质的性质,浓度和(11)等因素有关。
39. 三氢化五氨﹒一水合钴(Ⅲ)的化学式为(12),配位数为(13)
40.浓度均为0.1mol.kg-1的NaCl﹒CaCl2﹒HAc和C6H12O6水溶液的渗透压最大的是(14),最小的是(15)
41.苯甲醛自身进行Cannizzaro反映,所使用的试剂为(16)
42. 正戊烷以C2—C3为轴的优势对象的Newman投影式为(17)
43. 某碱性氨基酸溶液的PH3=3,此溶液中该氨基酸的主要存在形式是(18)离子
44. 1,4-二甲基-2-乙基环己烷的结构式是(19)
45.新戊烷、异戊烷和正戊烷中,沸点最低的是(20)
46. 化合物(21)
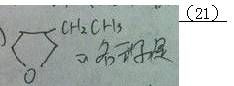
47. 化合物 (22)

48.完成反应式(写出主产物)(23)
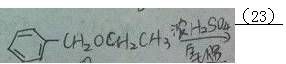
49.完成反应式(写出主产物)(24)
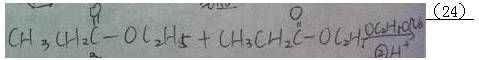
50. 完成反应式(写出主产物)(25)

51.制备苯乙醚常用的最佳原料为(26)和(27)(写原料名称)
52. 乳酸受热时脱水方式为分子(28)脱水,生成化合物的结构式是(29)
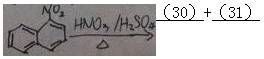
53. 完成反应式(写出主产物)(30)+(31)
54.化合物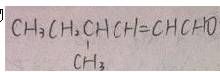 的系统命名是(32),该化合物有(33)个立体异构体。
的系统命名是(32),该化合物有(33)个立体异构体。
55. 完成反应式(写出主产物)(34)(35)
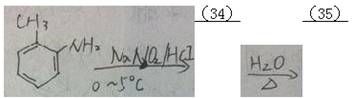
三、计算、分析与合成题:56—63小题,共55分。
56. 比较CO,N2和HF的沸点高低,并说明理由。
57. 请用配合物价键理论解释[Ni(CN)4]2-是反磁性的,而[Ni(NH3)4]2+是顺磁性的。
58.测定奶粉中Ca2+的含量。称取3.00g试样,经有机化处理溶解后,调节PH=10,以铬黑T作指示剂,用0.01000mol.L-1EDTA标准溶液滴定,消耗24.20mL。计算奶粉中钙的质量分数。已知M(Ca)=40.08g.mol-1
59.在血液中,H2CO3-HCO3-缓冲时的功能是从细胞组织中除去产生的乳酸(HLac),其反应式为
(1)求该反应的标准平衡常数Kθ
(2)正常血液中,c(H2CO3)=1.4×10-3mol.L-1, c(HCO3-)=2.7×10-2mol.L-1,假定血液的PH值由此缓冲液决定,求血液PH值。
60. 0.20mol.l-1NH3溶液与0.020 mol.l-1[cu(NH3)4]Cl2溶液等体积混合,是否有cu(OH)2沉淀生成?
61. 用简便并能产生明显的化学方法,分别鉴定下列两组化合物(用流程图表示鉴别过程)。
(1)溴化苄,环已酮,1-苯基乙醇
(2)β-苯基丙烯醛,β-苯基丙烯酸,丙酰乙酸甲酯
62.D-型丁糖A和B都能使溴水退色(反应1),能生成相同的糖脎(反应)经稀硝酸氧化后,A生成无旋光性的二酸,B生成有旋光性的二酸,分别写出A和B的fischer投影式,及反应1和反应2的反应方程式。
63.按照要求制备下列物质(写出每一步的反应方程式和主要反应条件,无机试剂任选):
(1)由 制备
(2)由 制备
(文章来源:文都教育)




