高中化学
化学实验在高考中是非常重要的,会以选择题和填空大题的形式出现,今天给大家分享必修一第一章的实验内容和要点~(马上点标题下蓝字"高中化学"关注可获取更多学习方法、干货!)
实验目录
第一章
从实验学化学
第一节 化学实验基本方法
【实验1-1】粗盐的提纯
【实验1-2】SO42-的检验
【实验1-3】蒸馏
【实验1-4】萃取
第二节 化学计量在实验中的应用
【科学探究】气体摩尔体积
【实验1-5】配制一定物质的量浓度的NaCl溶液
第一章 从实验学化学
第一节 化学实验基本方法
【实验1-1】粗盐的提纯
实验内容:
步 骤
现 象
1.溶解:称取约4 g粗盐加到盛有约12 mL 水的烧杯中,边加边用玻璃棒搅拌,直至粗盐不再溶解为止
固体食盐逐渐溶解而减少,食盐水略显浑浊
2.过滤:将烧杯中的液体沿玻璃棒倒入过滤器中,过滤器中的液面不能超过滤纸的边缘。若滤液浑浊,再过滤一次
不溶物留在滤纸上,液体渗过滤纸,沿漏斗颈流入另一个烧杯中
3.蒸发:将滤液倒入蒸发皿中,然后用酒精灯加热,同时用玻璃棒不断搅拌溶液,待出现较多固体时停止加热
水分蒸发,逐渐析出固体

思考分析
仅通过溶解、过滤、蒸发得到的固体仍然是不纯的食盐,因为从海水晒制的粗盐中除含有不溶于水的泥沙等杂质外,还含有可溶性的CaCl2、MgCl2及一些硫酸盐,这些杂质也被溶解,且过滤时进入滤液。检验这些离子存在的方法,可从分析它们盐在水中的溶解性得出。大多数硫酸盐都溶于水,而硫酸钡不溶于水,所以可用BaCl2溶液来检验硫酸盐。但钡盐除BaSO4外,还有BaCO3等,BaSO4不溶于稀盐酸,BaCO3等溶于稀盐酸。所以,检验硫酸盐时应2溶液,若产生的沉淀不溶于稀盐酸,则存在硫酸盐。同理,可用Na2CO3溶液检验CaCl2,用NaOH溶液检验MgCl2。
化学方程式
杂质
加入的试剂
化学方程式
硫酸盐(SO42-)
BaCl2
Na2SO4+BaCl2=BaSO4↓+2NaCl
MgCl2
NaOH
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
CaCl2
Na2CO3
Na2CO3+CaCl2=CaCO3↓+2NaCl
Na2CO3+BaCl2=BaCO3↓+2NaCl
HCl
Na2CO3+2HCl=CO2↑+H2O+ 2NaCl
HCl+ NaOH= NaCl+ H2O
【实验1-2】SO42-的检验
实验内容:
取【实验1-1】得到的盐约0.5克放入试管中,向试管中加入约2ml水配成溶液,先滴入几滴稀硝酸使溶液酸化,然后向试管中滴入几滴BaCl2(氯化钡)溶液。观察现象。
思考分析:
在进行物质检验时,一般先对试样的外观进行观察,确定其颜色、状态、气味等,然后准备试样进行检验。当试样是固体时,一般应将固体试样溶解,观察溶解后溶液的颜色、在溶解过程中有无气体产生、有无沉淀生成以及沉淀的颜色等。如需要加鉴别试剂检验时,应从溶液中取出一小部分,再滴加几滴试剂进行检验,观察现象。
检验硫酸根离子所用的试剂是BaCl2溶液、稀盐酸(或稀硝酸)。加入顺序可先加酸、再加BaCl2溶液,也可先加BaCl2溶液、再加酸。
实验现象
若先加酸、再加BaCl2溶液,则有白色沉淀生成即说明有SO42-存在;若先加BaCl2溶液、再加酸,应是有白色沉淀生成,加酸后沉淀不溶解证明含有SO42-。
化学方程式
Na2SO4+BaCl2=BaSO4↓+2NaCl
Na2CO3+ 2HCl = H2O + CO2↑+2NaCl
【实验1-3】蒸馏
实验内容:
实验
现象
1.在试管中加入少量自来水,滴入几滴AgNO3溶液和几滴稀硝酸。
2.蒸馏沸石(或碎瓷片),按图1-4连接好装置,向冷凝管中通入冷却水。加热烧瓶,弃去开始馏出的部分液体,用锥形瓶收集约10ml液体,停止加热。
AgNO3溶液和几滴稀硝酸。(得到的液体中有Cl-吗?)

思考分析:
实验室制取蒸馏水的目的是通过蒸馏除去水中的杂质。所以,本实验的设计是,先检验自来水中含有氯离子,然后将自来水蒸馏,再检验所得的蒸馏水中是否含有氯离子。若蒸馏后的水中检验不出氯离子,则说明自来水中的氯离子已通过蒸馏除去。
由于【实验1-1】、【实验1-2】只介绍了SO42-的检验(讨论了Ca2+、Mg2+的检验),在做此实验前应先讨论实验的目的、氯离子的检验方法和蒸馏装置特点,再进行实验。实验中各步的现象:
实 验
现 象
1.自来水中氯离子的检验
加AgNO3溶液后有白色沉淀,再加稀硝酸,沉淀不溶解。
2.蒸馏,制蒸馏水
加热,烧瓶中水温升高至100 ℃后沸腾。在锥形瓶中收集到蒸馏水。
3.检验蒸馏水中是否含有氯离子
加AgNO3溶液和稀硝酸,蒸馏水中无沉淀。
【实验1-4】萃取
实验内容:
1.用量筒量取10ml碘的饱和水溶液,倒入分液漏斗,然后再注入4ml四氯化碳,盖好玻璃塞;
2.用右手压住分液漏斗口部,左手握住活塞部分,把分液漏斗上倒转过来用力振荡;
3.将分液漏斗放在铁架台上,静置。
4.待液体分层后,将分液漏斗上的玻璃塞打开,或使塞上的凹槽(或小孔)对准漏斗上的小孔,再将分液漏斗下面的活塞打开,使下层液体慢慢流出。
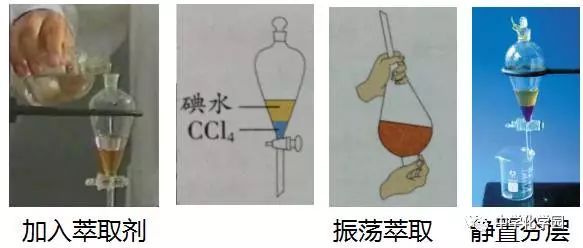

思考分析:
实验前介绍萃取的原理和萃取、分液的专用仪器──分液漏斗;讲清加萃取剂、用力振荡、分液前打开玻璃塞、分液时控制活塞等操作的目的。
实验现象
(1)加四氯化碳时,四氯化碳不溶于水,密度比水的大,在下层;
(2)用力振荡的目的是使水与四氯化碳充分混合;
(3)静置后四氯化碳层变紫色,水层黄色变浅或接近无色。
第二节 化学计量在实验中的应用
【科学探究】气体摩尔体积
1.电解水实验,比较产生的1 mol H2和 O2的体积大小
(1)电解水实验,生成的O2和H2的体积比是多少?
(2)假设电解了1.8 g水,试计算所得H2 和O2的物质的量之比是多少?
质量
物质的量
H2 和O2的物质的量之比
H2
0.2 g
0.1 mol
2:1
O2
1.6 g
0.05 mol
2.计算标准状况 (0℃、101kPa)下 1 mol气体的体积
物质
状态
粒子数
质量
密度
体积
H2
气体
6.02×1023
32 g
1.429 g/L
22.4 L
O2
气体
6.02×1023
2.016 g
0.0899 g/L
22.4 L
结论:相同条件下,1mol不同的气体,其体积是相同的。
3.已知密度,计算20℃时1 mol 不同物质的体积
物质
状态
粒子数
1mol物质质量(g)
密度(g/cm3)
体积(20℃)(cm3)
Fe
固
6.02×1023
56
7.86
7.2
Al
固
6.02×1023
27
2.70
10
Pb
固
6.02×1023
207
11.3
18.3
H2O
固
6.02×1023
18
0.998 (4℃)
18
H2SO4(纯)
固
6.02×1023
98
1.83
53.6
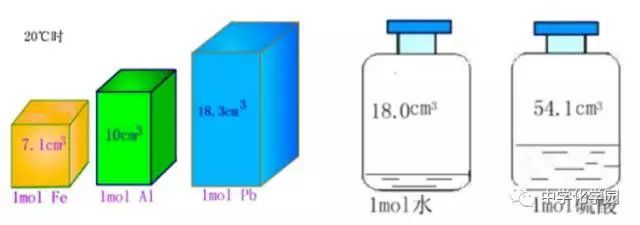
结论:相同条件下,1mol不同的固体或液体物质,其体积是不相同的。
【实验1-5】配制一定物质的量浓度的NaCl溶液
实验内容:
配制100ml1.00mol/LNaCl溶液。
1.计算需要NaCl固体的质量;
2.根据计算结果,称量NaCl固体;
3.将称好的NaCl固体放入烧杯中,用适量蒸馏水溶解。
4.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2-3次,洗涤液也都注入容量瓶。轻轻晃动容量瓶,使溶液混合均匀。
5.将蒸馏水注入容量瓶,液面离容量瓶颈刻度线下1-2cm时,改用胶头滴管滴加蒸馏水至液面与刻度线相切。盖好瓶塞,反复上下颠倒,摇匀。
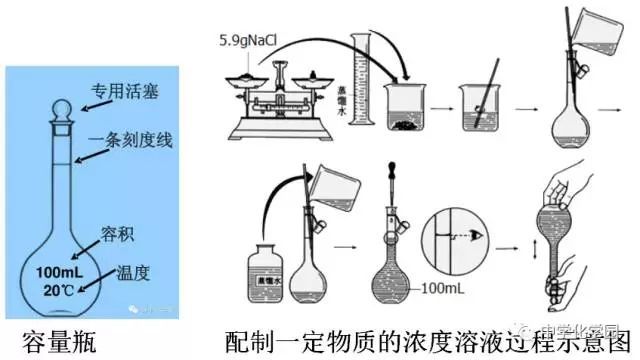
原理:
m=n·M
思考分析:
(1)选用配制NaCl溶液,是因为NaCl价廉。配制100 mL,也是考虑所配的NaCl溶液用处不大,减少浪费。目前有的学校条件比较好,配备了分析天平,可用分析天平来称量。若用托盘天平,可向学生简单说明感量问题即可。此实验的目的是使学生学习配制溶液的方法和技能。
(2)教学中教师可以先演示,然后学生再进行实验。
(3)学生实验后可进行一些误差分析。
溶液配制的误差分析
nB不变→V减小则cB增大;V增大则cB减小;
V不变→nB减小则cB减小;nB增大则cB增大。
可能引起误差的操作
c(mol∙L-1)
天平的砝码上粘有其他物质或已锈蚀
偏高
试剂与砝码的左右位置搞错
偏低
量取液体溶质(如浓硫酸)时,俯视读数
偏低
定容时俯视刻度线
偏高
所配溶液未冷却至室温即转入容量瓶定容
偏高
转移溶液时不洗涤烧杯与玻璃棒或未将洗涤液转入容量瓶
偏低
溶解、转移、洗涤时有溶液流出容器外,使溶质减小
偏低
容量瓶在使用前,用蒸馏水洗净,在瓶内有少 量水残留
无影响
定容摇匀后,静止时发现液面低于刻度线,再加水到刻度线
偏低
如配制氢氧化钠溶液,用滤纸称量氢氧化钠
偏低
Tips:
▍本文编辑:化学姐
▍来源:本文来源网络,版权归相关权利人所有,如侵权,请联系删除

